Ngày 11 tháng 04 năm 2016, Cục quản lý thực phẩm và dược phẩm Hoa Kỳ (FDA – Food and Drug Administration) đã chấp thuận lưu hành Venclexta (Venetoclax) để điều trị lơ xê mi kinh dòng lympho (CLL) với bất thường mất cánh ngắn NST số 17 mà đã từng được điều trị ít nhất một lần trước đó. Venclexta là thuốc đầu tiên được FDA chấp thuận điều trị nhắm đích protein lympho tế bào B 2 (B cell lymphoma 2 – BCL 2) – yếu tố hỗ trợ sự tăng trưởng của tế bào ung thư và được biểu hiện quá mức ở các bệnh nhân CLL.
Theo thông tin của Viện ung thư quốc gia Hoa Kỳ, CLL là một loại bệnh phổ biến nhất trong lơ xê mi ở người lớn với khoảng 15 000 ca bệnh mỗi được chẩn đoán mỗi năm. CLL được đặc trưng bởi tích lũy tăng dần của các tế bào bạch cầu bất thường. Các bệnh nhân mắc CLL có mất đoạn cánh ngắn NST 17 – có tác động ngăn chặn sự phát triển của ung thư. Bất thường về NST này xảy ra ở khoảng 10% bệnh nhân chưa được điều trị CLL và ở khoảng 20% bệnh nhân CLL tái phát.
Tại Viện Huyết học – Truyền máu Trung ương, bình quân có khoảng 30 bệnh nhân mới được chẩn đoán mỗi năm. Trong những bệnh nhân CLL, tổng số có 24 bệnh nhân làm xét nghiệm kiểm tra bất thường về di truyền với các marker của CLL bằng kỹ thuật FISH, trong đó, có 2 bệnh nhân được phát hiện đột biến mất cánh ngắn NST 17 (~ 8%). Tuy nhiên, số lượng bệnh nhân làm xét nghiệm về di truyền còn thấp nên số lượng và tỷ lệ bệnh nhân CLL có đột biến mất cánh ngắn NST số 17 có thể sẽ thay đổi trong thời gian tới
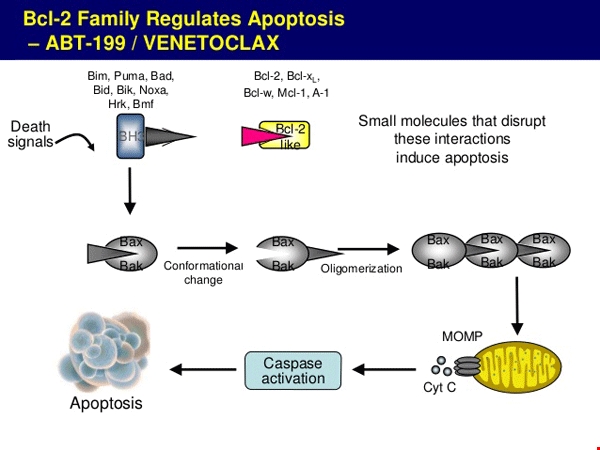
Sự điều tiết chết theo chu trình của BCL-2 và cơ chế tác dụng của Venetoclax.
Venclexta (Venetoclax) là thuốc điều trị nhắm đích mới, là thuốc nhắm đích đầu tiên ức chế BCL-2 (hình 1). Venetoclax được chỉ định cho bệnh nhân CLL có đột biến mất cánh ngắn NST 17 đã từng điều trị với liệu pháp khác nhưng không có đáp ứng, đã mở ra cơ hội và sự lựa chọn mới trong điều trị CLL. Ngoài ra, venetoclax được cấp phép cho chỉ định hiếm (orphan designation) trong điều trị lơ xê mi cấp dòng tủy bởi Ủy ban Châu Âu (European Commission) vào 17/02/2016.
Thử nghiệm lâm sàng đánh giá hiệu quả của Venclexta ở 106 bệnh nhân CLL có đột biến mất cánh ngắn NST 17 đã từng được điều trị trước đó. Những người tham gia được uống Venclexta mỗi ngày với liều khởi đầu 20 mg và tăng dần trong 5 tuần lên tới 400 mg. Kết quả cho thấy rằng 80% bệnh nhân đạt được lui bệnh hoàn toàn hoặc lui bệnh một phần.
Venclexta chỉ được chỉ định sử dụng hàng ngày ở các bệnh nhân đã được xác định có đột biến mất cánh ngắn NST 17 bằng kỹ thuật FISH.
Các tác dụng phụ thường gặp nhất của Venclexta bao gồm giảm bạch cầu (đặc biệt bạch cầu đa nhân trung tính), tiêu chảy, buồn nôn, thiếu máu, nhiễm khuẩn đường hô hấp trên, giảm tiểu cầu và mệt mỏi. Các biến chứng nghiêm trọng bao gồm viêm phổi, sốt giảm bạch cầu trung tính, sốt, thiếu máu do tan máu tự miễn, thiếu máu và các bất thường về chuyển hóa như hội chứng ly giải khối u. Nên tránh sử dụng các vaccin sản xuất từ vi khuẩn hoặc virus bị làm yếu hoạt tính.
Venclexta được sản xuất bởi AbbVie Inc. địa chỉ tại Bắc Chicago, Illinois, Hoa Kỳ và được phân phối bởi AbbVie and Genentech USA Inc. địa chỉ tại Nam San Francisco, California, Hoa Kỳ.
Mọi thông tin liên quan tới sản phẩm – xem tờ hướng dẫn của sản phẩm: http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/208573s000lbl.pdf
TÀI LIỆU THAM KHẢO
1. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm495253.htm,Page Last Updated: 04/11/2016
2.http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/208573s000lbl.pdf
3.http://reference.medscape.com/drug/venclexta-venetoclax-1000078#0
4.http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/orphans/2016/04/human_orphan_001718.jsp&mid=WC0b01ac058001d12b#
5.Stephen Mulligan, "Breakthroughs in Chronic Lymphocytic Leukemia 2014-2015”, APHCON/BTG 2015, Beijing, 1st February, 2015
Nguồn : Viện Huyết học - Truyền máu Trung Ương